ラミニン、癌、肝臓を 3 つの柱としたプロジェクトを展開中
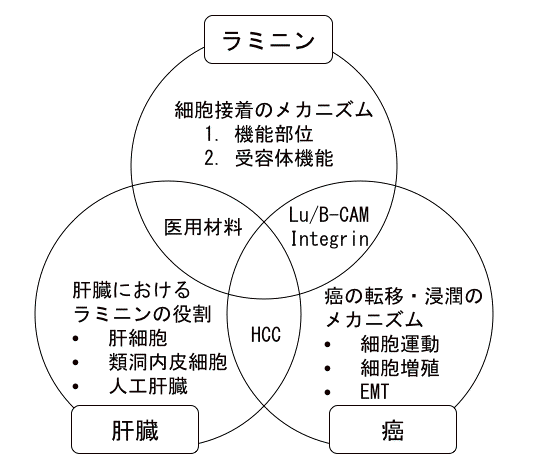
ラミニン:基底膜の主要な成分で細胞の接着を担う糖蛋白質
Lu/B-CAM:ラミニンα5鎖の受容体
Integrin:細胞外マトリックスの受容体
HCC:肝細胞癌 (hepatocelluler carcinoma の略)
EMT:epithelial-mesenchymal transition の略
これまでの研究概要
基底膜 (basement membrane) は組織の境界に存在する厚さ約 50 nm の薄い膜である。基底膜の主要成分であるラミニン・アイソフォーム (図 1) は組織構造を維持するだけでなく、個体発生や癌の浸潤・転移など、多様な場面で関係する機能性蛋白質である。また、ES 細胞や組織幹細胞の研究から、Niche (ニッシェ) の概念にもとづいて活気づく細胞外環境という分野の一角を担う重要な蛋白質である。大学院博士課程よりこのラミニンについて研究を行っている。
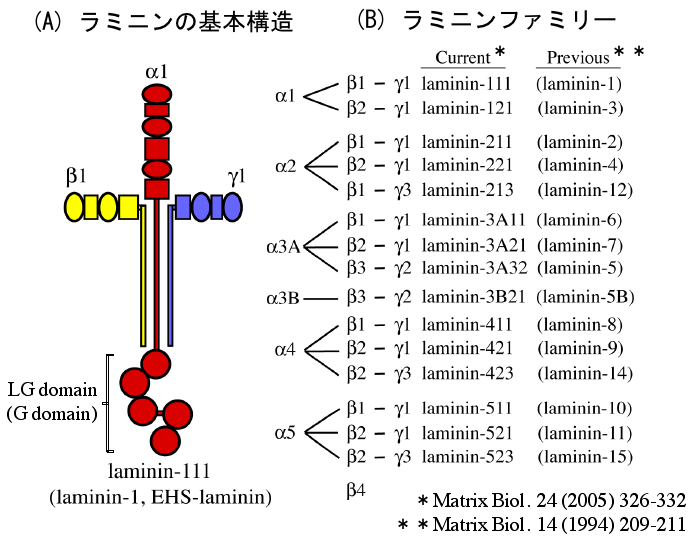
図 1 (A) ラミニン・ファミリーは、α, β, γ の 3 つのサブユニットからなる分子量 500-900 kDa のタンパク質で十字架の構造を持つ。ラミニン-1 (α1, β1, γ1) は、最初に発見されたラミニンで EHS-laminin とも呼ばれる。(B) ラミニン・アイソフォームの組み合わせ。それぞれのサブユニットをコードする遺伝子は、5 種類のα鎖、3 種類のβ鎖、3 種類のγ鎖が知られている。現在までに、15 種類のアイソフォームの存在が確認されている。
大学院在学中に、横浜市立大学木原生物学研究所の宮崎香 助教授 (現教授) のもとで癌の浸潤・転移に関わるタンパク質の探索研究 (現在のプロテオーム解析) を行い、精製した癌細胞由来の細胞分散因子が当時未同定であったラミニン-5 であったことに大きな影響を受け、以来一貫してラミニンについて研究を行ってきている。ラミニン-5 の研究においては、これまでの細胞外マトリックスには見られない強力な細胞接着活性あること、また相反するように運動促進活性を持つことなど、ラミニン-5 がユニークなタンパク質であることを報告してきた (Pro. Natl. Acd. Sci. 90, 11767-11771, 1993; J. Biochem. 116, 862-869, 1994; In Vitro Cell. Dev. Biol. 32, 46-52, 1996)。ラミニン-5は、他の研究グループによって遺伝性の皮膚疾患の原因遺伝子として同定されるなど、疾患との関わりでさらに注目が集まっている。
大阪府立母子保健総合医療センター研究所・関口清俊 所長 (現 大阪大学蛋白質研究所教授) のもとで、ラミニンα5 鎖を含みラミニンのプロトタイプとされるラミニン-10/11 を世界に先駆けて精製し、その受容体がラミニン-5 と同じインテグリンα3β1 であることを報告した (J. Biol. Chem., 273, 15854-15859, 1998; J. Cell Sci., 113, 869-876, 2000)。また報告の中で、これまで同一とされてきたマウス EHS ラミニンとヒト胎盤ラミニンにおける受容体特異性や抗体による組織染色像の矛盾がヒト胎盤ラミニンに含まれるラミニン-10/11 によることを明らかにし、ラミニン研究における問題点を解決した。以上の成果は、ラミニンの構造と機能を生化学、細胞生物学そして分子生物学的手法を用いて in vitro で研究してきた。
米国セントルイス ワシントン大学の Dr. Miner の研究室において、in vitro で得たラミニン-10/11 の知見を in vivo で検証するために、トランスジェニックマウスやノックアウトマウスなどの発生生物学的手法を導入し、胚発生や腎臓機能におけるラミニンの役割を明らかにしてきた (J. Biol. Chem. 277, 44864-44869, 2002; J. Cell Biol. 161, 187-196, 2003; Dev. Biol. 296, 266-2777, 2006)。なかでも、ラミニンα5 鎖の遺伝子の一部に変異を導入したマウスの研究から、ラミニンα5 鎖が蛋白尿を伴った腎機能障害を引き起こす原因遺伝子になる可能性を示唆した (図 2)。現在、ヒトの腎臓病でそのような変異が実際に起きているのか検証が行われている。
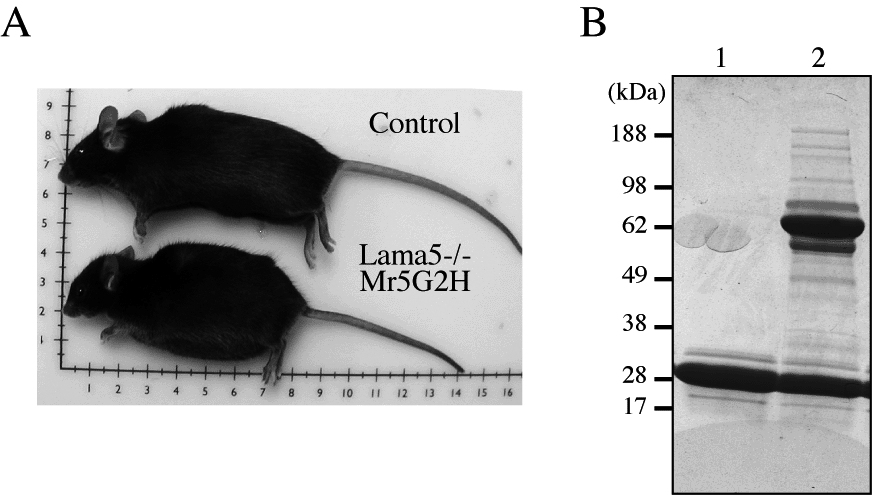
図 2 (A) ラミニンα5 鎖の遺伝子の一部に変異を導入したマウス (下: Lama5-/-Mr5G2) は、コントロール (上: Control) に比べて成長が悪く、腹水が溜まるようになる。(B) 尿を SDS-PAGE によって解析した結果。Lane 2 の遺伝子改変マウスでは、64 kDa 付近にアルブミンの漏出が認められる。
札幌医科大学では科学研究費のサポートを受け、三高俊広教授とともに肝臓の再生や組織幹細胞に関する研究を行った。そのなかで、ラミニンα1 鎖を含むラミニンが肝臓の再生に関与することを見いだした (Exp. Cell Res. 305, 99-109, 2005; Connect. Tissue Res. 46, 193-199, 2005; J. Hep. 45, 90-98, 2006)。この結果は、ラミニンが肝臓の再生という生物現象への関与にとどまらず、人工肝臓といった組織工学の分野で有効な生体材料になることを示した。
これまでにラミニン研究の礎となる重要な論文を報告し、さらに研究を推進している。2005 年の 4 月から東京薬科大学へ異動し、これまでのラミニン研究を再生医学へ応用すべく、東京薬科大学薬学部・野水基義教授の協力を得て人工基底膜の研究を行っている。