研究内容
【 研究内容 】
人工細胞膜とエクソソームの膜融合
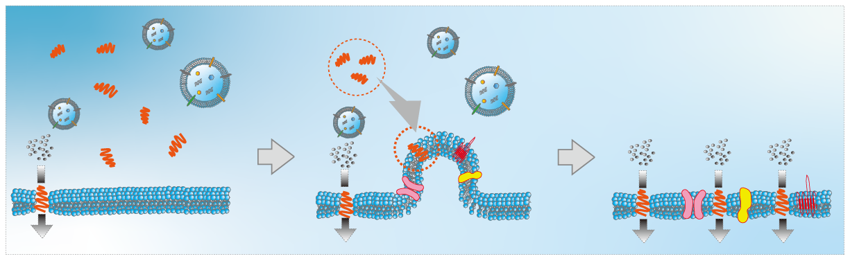
エクソソーム(直径が 100 nm 程度の細胞外小胞)は、遠く離れた場所に位置する細胞同士のコミュニケーションのツールとして認識されています。
私たちは、グラミシジン(一価の陽イオンチャネル)を包埋させた人工細胞膜にエクソソームを添加すると、エクソソームの膜融合に伴い、包埋されるグラミシジンの分子数が増大する現象を見出しました。この現象を利用することで、人工細胞膜とエクソソームの膜融合を観察できるようになり、生体内では pH や脂質組成で膜融合がコントロールされていることを示唆するデータも得ています。
今後、人工細胞膜界面のデザインにより、本来の生体機能を飛び越えて、ターゲットとなる細胞から放出されたエクソソームのみを選択的に膜融合できるようにし、これを分析化学に応用したいと考えています。
- M. Nishio, Y. Teranishi, K. Morioka, A. Yanagida, A. Shoji, Real-time assay for exosome membrane fusion with an artificial lipid membrane based on enhancement of gramicidin A channel conductance, Biosens. Bioelectron., 2020, 150, 111918.
- 科学研究費補助金(基盤研究C) 2018–2020年度 人工細胞膜との特異的膜融合を利用するエクソソーム膜タンパク質の高感度計測法 3,400千円(直接経費)東海林(代表)
- 公益財団法人 精密測定技術振興財団 2021年度 膜タンパク質計測が切り拓くエクソソームの質変化の解析法 2,500 千円(直接経費)東海林(代表)
- 分析化学イノベーションフォーラム助成 2020年度 10月-2023 年度 2 月生体膜デザインコンファレンス 7,00 千万 東海林(代表)
無電解メッキ技術に基づく光ファイバー表面プラズモン共鳴センサー
生体機能を理解する上で、生体内で形成される微小空間の“その場”かつ“リアルタイム”で細胞から分泌される生体分子を計測することが重要であると考えられます。
このような分析技術は、現在においても十分に克服できてるとは言い難いのが現状です。
私たちは、この課題を克服するためのツールとして光ファイバー表面プラズモン共鳴センサーに着目し、無電解メッキ技術により、光ファイバーのコアに再現よく50 nm の膜厚で金を被覆する技術を確立しました。
この技術のポイントは、膜厚をモニターしながら、金ナノ薄膜を被覆する点にあります。
細胞から分泌されるエクソソームをリアルタイムで“その場”計測できる技術の確立を目指しています。
- K. Morita, K. Morioka, H. Nakajima, K. Uchiyama, A. Yanagida, A. Shoji, Film-Thickness-Controllable System for Preparing Silver Nanofilms through Absorbance Monitoring of the Thickness during a Silver-Mirror Reaction, Anal. Sci., 2021, 37, 625-631.
- 科学研究費補助金 (基盤研究C) 2021–2023年度 神経細胞近傍のエクソソーム動態計測を目指した微小センサーの開発 3,400千円(直接経費)東海林(代表)
- 科学研究費補助金 (挑戦的研究(萌芽)) 2021–2022年度 表面プラズモン共鳴センサーを用いる呼気凝縮液中エクソソーム分析法の開発 1,500 千円(直接経費)東海林(分担)
- JST 研究成果最適展開支援プログラム(A-STEP) 機能検証フェーズ 試験研究タイプ 2018年 9月-2019 年 8月 ナノメートルオーダーで膜厚を厳密に制御できる革新的な無電解めっき技術の確立 1,950 千円(直接経費)東海林(代表)
ガラスキャピラリーを試料セルに用いる小型蛍光検出器 "CapilaReader"
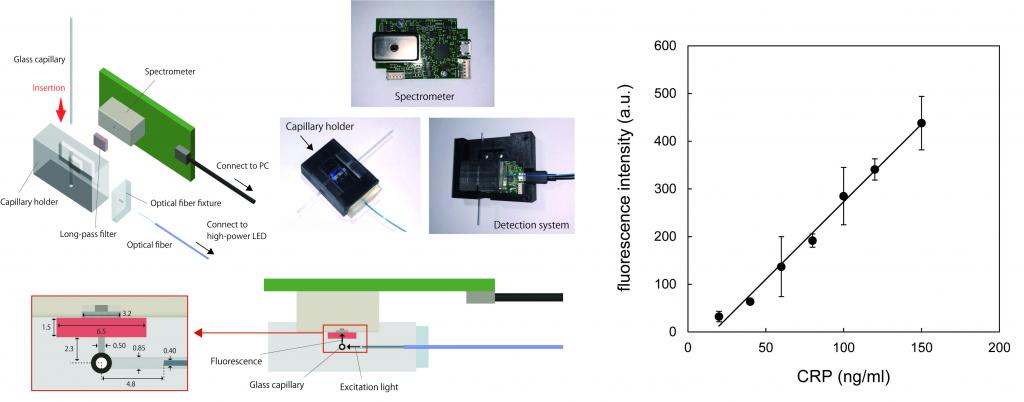
ガラスキャピラリーは、表面積対体積比が大きく、シランカップリングにより内壁に様々な官能基を導入できます。また、毛管力により溶液をキャピラリー内に吸入することが可能であるため、サンプリング能を備えたバイオセンサーとしての応用が期待されています。しかし、キャピラリー内の溶液やラベル化した物質を蛍光で検出する場合、顕微鏡や蛍光イメージャーなど大型で高価な専用装置を必要とするため、現場での医療診断に応用することは困難です。
私たちの研究室では、ガラスキャピラリー用の小型蛍光検出器を独自に開発しました。光源と検出器をキャピラリーに直交させるように配置し、キャピラリー内の溶液に励起光を照射して発した蛍光のみを、分光器で検出できるような装置を設計しました。検出器の大きさは手のひらサイズであり、容易に持ち運ぶことができます.この蛍光検出器を、ガラスキャピラリーを用いる酵素免疫測定法 (キャピラリー ELISA) による C 反応性タンパク(CRP)の測定に応用し,血清中に含まれる CRP の定量に成功しました。この装置は、ガラスキャピラリーを挿入するだけで手軽に測定できるため、ポイントオブ検査 (POCT) や居宅での自己検査などへの応用が期待されます。
オンチップ技術によるマイクロチップへの機能集積化
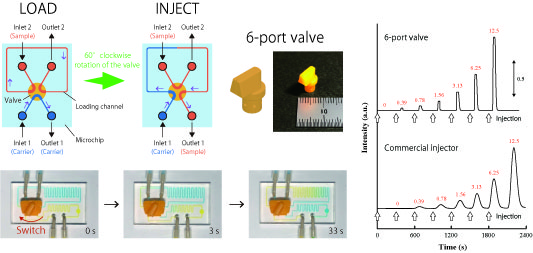
マイクロチップは、生体機能の評価やがん検査など、研究・実用レベルで使用される革新的な分析ツールです。マイクロチップを用いる分析法は、µm サイズの微細流路(マイクロチャネル)を利用することで、試料・試薬量の低減,拡散距離の短縮による反応時間の短縮(分析時間の短縮)などが可能になります。しかし、マイクロチップを使用する分析は、送液ポンプ、インジェクター、検出器などの様々な大型で高価な周辺機器をチップと組み合わせて行う必要があるため、多くの実験室で扱えるわけではありませんし、実用化した装置もそれほど多くありません。
私たちの研究では、より多くの実験室、そして実用レベルでマイクロチップを取り扱うことのできる技術の開発に取り組み、「周辺機器の機能を集積化したマイクロチップ」の実現を目指しています。これまでに、マイクロチップ上に流路切り替えバルブ(6方)バルブを統合した、オンチップ試料注入システムを開発しました。これにより、外付けのインジェクターが無くても、微少量の試料を精確に注入することができます。このようなオンチップ技術は、幅広い分野の研究や、検査技術の発展に貢献できると考えています。
- K. Morioka, H. Sato, K. Morita, A. Hemmi, H. Nakajima, A. Shoji, A. Yanagida, Development of an on-chip sample injection system with a 6-port valve incorporated in a microchip, RSC Adv., 2020, 10, 35848-35855.
- 新型コロナウイルス感染症対策支援事業 2020~2021 年度, 検査従事者が低リスク・少労力で使用できる小型リアルタイム RT-PCR システム, 森岡和大(代表), 800千円.
- 科学研究費補助金 若手研究(B) 2017~2019 年度, コンパクトディスク型マイクロチップを用いるオンサイト遺伝子検査システムの開発, 森岡和大(代表), 3,400千円,
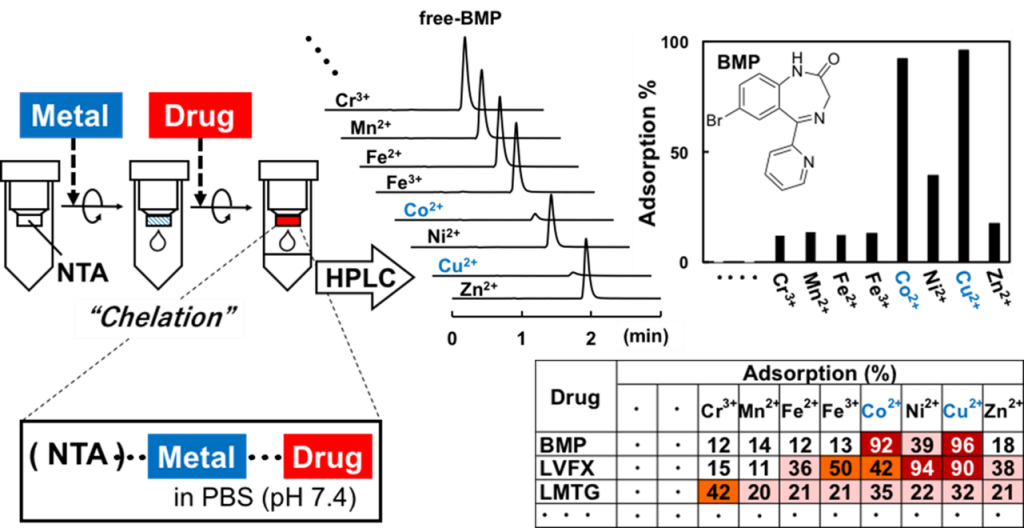
金属イオンと薬物間の相互作用(錯体形成)検出用の High-throughput スクリーニング法
日本薬局方医薬品の中には、金属イオンとの親和性の高い多座配位子構造を有するものが多数あります。また、金属イオンとの錯体形成に伴い、薬物の吸収挙動や薬効の変化や、予期せぬ副作用や配合変化が生じた事例の報告もあります。しかしながら、金属イオンと薬物の膨大な組合せに対して、両者間の金属錯体形成の有無を網羅的に検出できる分析法は確立されていませんでした。
そこで私たちは、金属イオンと薬物間の錯体形成を網羅的かつ迅速に検出するためのハイスループットスクリーニング法の構築を検討してきました。現在までに、①(任意の金属イオンをキレートさせた)固相抽出媒体とHPLC分析を組み合わせた方法(図を参照)や、②金属イオン含有二相溶媒系を用いる高速向流クロマトグラフィー法、③イオン選択性電極法、④二相溶媒系を用いる分配係数測定とフローインジェクション分析を組み合わせた方法、などを開発しています。また、各方法によるスクリーニングを実施して、これまでに報告例のない様々な錯体形成の組合せを発見しています。
多品目の薬物の病院内TDM実施のための 実用的なHPLC装置と血中濃度定量法
医療現場(病院)における血中薬物濃度定量に基づく治療薬物モニタリング(TDM)の実施は、投与された薬物の治療効果や副作用を見極める上で重要ですが、その定量分析法は薬物ごとに異なり、複雑な前処理や特殊な試薬・機器類も必要なため、病院内での TDM の実施は決して容易ではありません。そこで私たちは、多品目の薬物に対して、ほぼ同一手順の前処理(固相抽出)操作と単一装置での HPLC分析(逆相HPLC/UV 検出)を行う、迅速で実用的な血中濃度定量法と専用装置を開発しました。
*本研究は、JA長野厚生連北信総合病院・薬剤部と、(株)日立ハイテクサイエンスとの共同研究・開発です。
現在、開発した方法と装置を用いて、すでに20種類以上の薬物や中毒起因物質の分析条件が構築できており、病院の常勤スタッフ(臨床検査技師や薬剤師)が日常的に実施する院内測定法としての有用性の検証や活用が、全国の病院でスタートしています。

(株)日立ハイテクサイエンス「LM1010高速液体クロマトグラフ」製品紹介はこちら
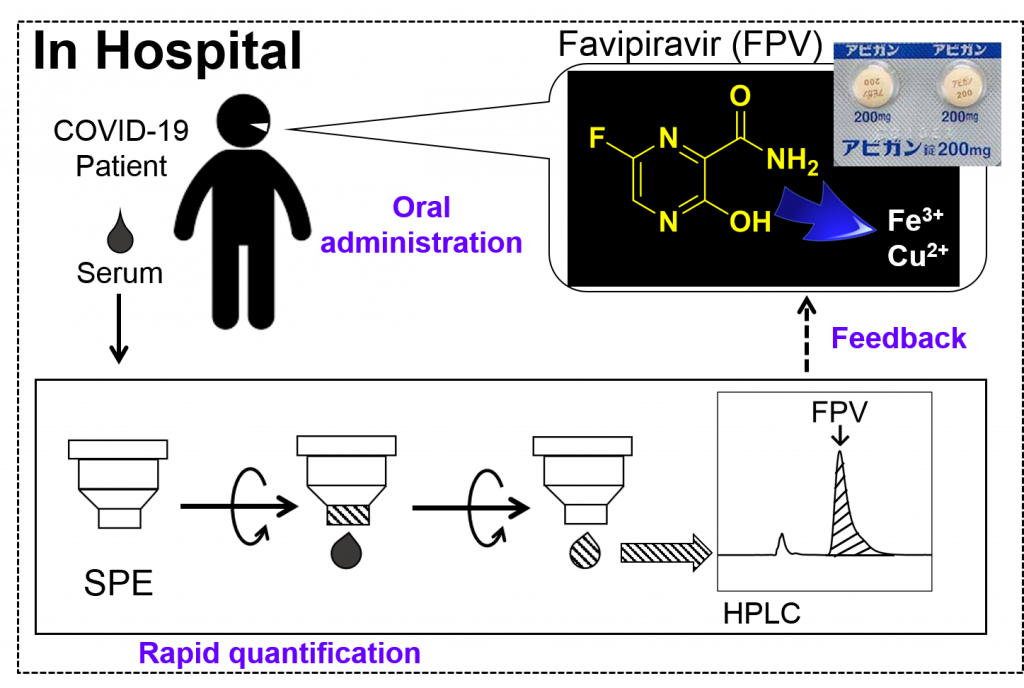
COVID-19 治療薬ファビピラビルの病院内TDM用の血中濃度定量法
猛威を振るう新型コロナウイルス感染症(COVID-19)に対して、その治療薬の開発や治験が世界中で進められています。私たちの教室では、JA長野厚生連北信総合病院との共同研究として、2014年に日本で承認された経口抗インフルエンザウイルス薬(アビガン錠)の主成分ファビピラビル(FPV)の血中濃度定量法を確立しました。この方法は、COVID-19の患者を受け入れている市中病院で(アビガン錠投与後の)血中FPV濃度モニタリングを行うために、病院の常勤スタッフが実施可能な簡便性と迅速性を備えた手法として(前出のHPLC装置を用いて)最適化されました。さらに、当教室で独自開発した分析手法より、生理的なpH条件下でFPVは特定の金属イオン(特にFe3+)と選択的に錯体形成することを世界で初めて明らかにしました。この結果を元に、さらに共同研究先の病院で血中FPV濃度とフェリチン濃度の相関研究が進められています。
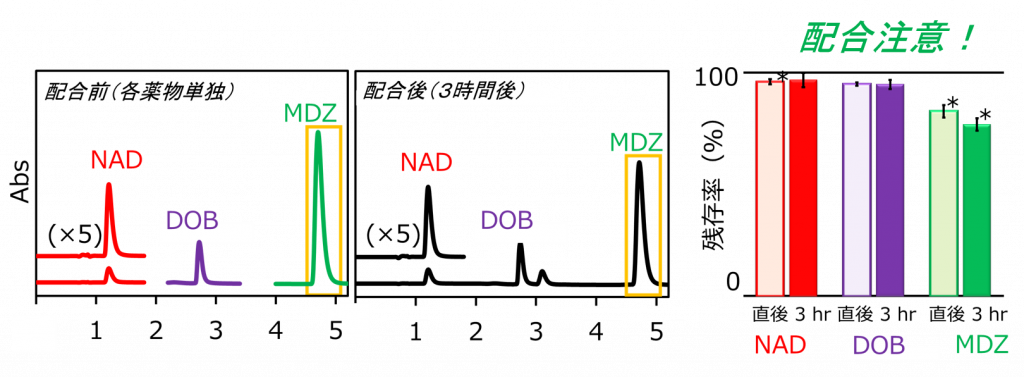
救命救急現場での持続性注射剤の多剤配合の可否判定分析
救命救急の現場では、同一点滴ルートから2剤以上の注射薬を同時投与せざるを得ない場合があり、投与経路中での配合変化のリスクが伴います。しかし、製薬メーカーから提供されているのは2剤配合時の主剤(自社品)に関する情報のみであり、副剤の情報は含まれていません。また、3剤以上の多剤配合に関する情報もありません。このようなリスクに対して、実際の医療現場では、(色調や濁りなどの)外観変化で配合変化の有無を判断していますが、外観では判別できない配合変化の事例はほとんど検証されていませんでした。私たちの教室では、日本医大多摩永山病院薬剤部との共同研究として、救命救急センターで使用頻度の高い持続性注射薬(ノルアドレナリン、バソプレシン、アミオダロンなど)をベース薬剤として選択し、それらと併用頻度が高い様々な薬剤との2剤及び多剤配合試験を実施しています。配合した全ての薬剤の含量変化をHPLCで経時的にモニタリングすることで、これまでに知られていなかった「外観変化を伴わない多剤配合変化(配合注意や不適)」の組合せを多数見出すとともに、配合の「適・不適」の判定結果を臨床現場へフィードバックしています。
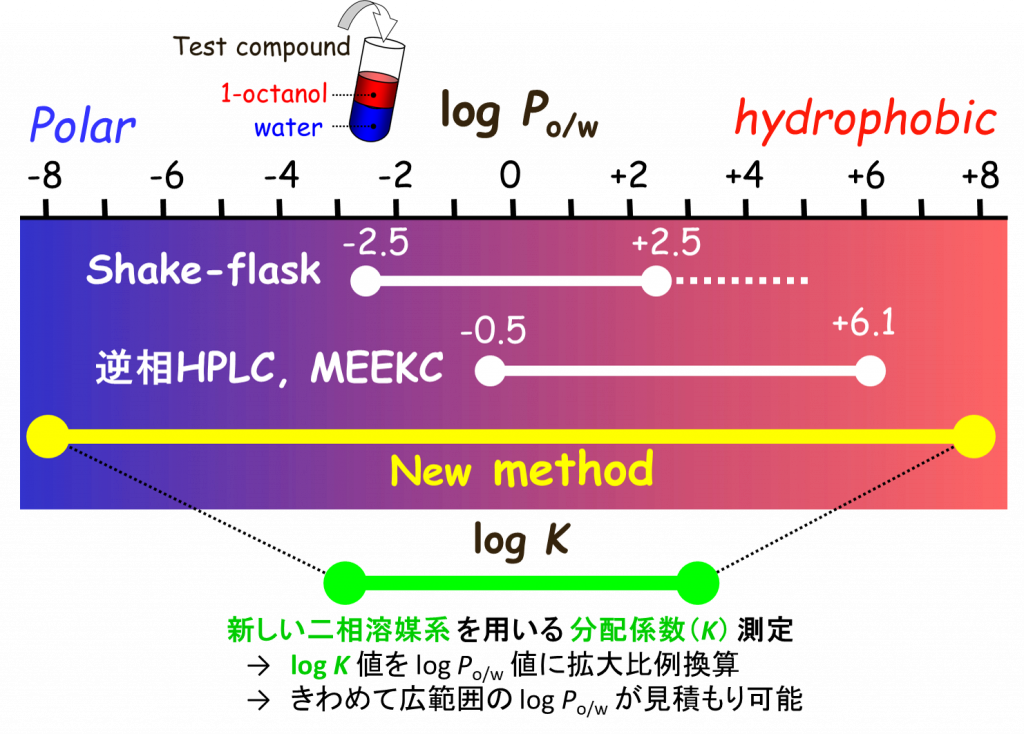
薬物のオクタノール/水 分配係数log P の“超”広範囲スクリーニング法
1-オクタノール/水二相溶媒系における薬物や生体成分の分配係数(Po/w:以下Pと略)の対数値log Pは、薬理活性や生体内での薬物吸収・分布・代謝・排泄挙動を予測する上で有用な物性値です。しかし、既存のlog P測定法は測定範囲が狭く、特に親水性(高極性)化合物の負の値がほとんど計測できませんでした。私たちの教室では、(従来のオクタノール/水系に代わる)新しい組成の二相溶媒系を用いる分配法と、フローインジェクション分析(FIA)による迅速濃度測定を組み合わせた独自のlog P計測システムを開発しました。この方法は、“超”広範囲のlog P値(-8~+8)を計測できる世界で唯一の方法であり、これまで実測されたことが無い薬物、生理活性物質、高極性アミノ酸、ペプチド、タンパク質、オリゴヌクレオチドなどのlog P値の計測が行われています。